本学薬学部の渡辺賢二教授、岸本真治助教のグループは、生物がアルカロイドの立体異性体を作り分けるメカニズムの解明に成功しました。
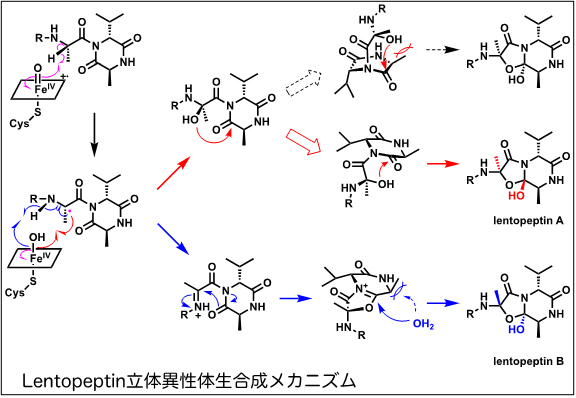
エルゴぺプチンは代表的な麦角アルカロイドの1つであり、リゼルグ酸と特殊な環状トリペプチドが結合した骨格を持っています。今回、研究グループは糸状菌Aspergillus lentulusからレントぺプチンA、Bと命名した二種類のアルカロイドを単離し、化学構造を決定するとともにその生合成メカニズムを明らかにしました。興味深いことにレントペプチンは一般的なリゼルグ酸部分が桂皮酸に置き換えられた構造を有し、また、環状トリペプチドの自発的分子内環化に必要なプロリン残基を欠いていました。研究グループはこの特殊な環構造の形成を触媒する酵素を明らかにしました。さらにレントぺプチン生合成酵素の一つである酸化酵素を試験管内で反応させたところ立体異性体の関係にあるレントぺプチン AとBを同時に観測するという予想外の結果を得ました。このメカニズムについて詳細に調べたところ、レントぺプチン Aは、分子内で立体特異的ヒドロキシ化と自発的な二環性ラクタム環形成により生合成され、一方、レントぺプチンBは、はじめの脱水素化とそれに続く二環性ラクタム環形成および立体特異的水酸化によって生合成されることが分かりました。すなわち、酸化酵素が二つの異なる経路を触媒することで一つの化合物から二種類の化合物を生成していることが明らかになりました。これらの実験結果から、天然ではごくありふれた酵素を使って天然物の複雑な化学構造にさらに多様性を与えていることを明らかにしました。
本成果は、化学分野において最も権威のある国際化学雑誌「Journal of the American Chemical Society」(Impact Factor: 15.419) 電子版に2022年3月18日付けで掲載されました。
〈掲載された論文〉
Alkaloid Biosynthetic Enzyme Generates Diastereomeric Pair via Two Distinct Mechanisms
Shinji Kishimoto, Yuya Matsubara and Kenji Watanabe
【関連リンク】
American Chemical Society
https://pubs.acs.org/doi/10.1021/jacs.1c13621(外部サイトへリンク)
(2022年3月22日)
本成果は、化学分野において最も権威のある国際化学雑誌「Journal of the American Chemical Society」(Impact Factor: 15.419) 電子版に2022年3月18日付けで掲載されました。
〈掲載された論文〉
Alkaloid Biosynthetic Enzyme Generates Diastereomeric Pair via Two Distinct Mechanisms
Shinji Kishimoto, Yuya Matsubara and Kenji Watanabe
【関連リンク】
American Chemical Society
https://pubs.acs.org/doi/10.1021/jacs.1c13621(外部サイトへリンク)
(2022年3月22日)




