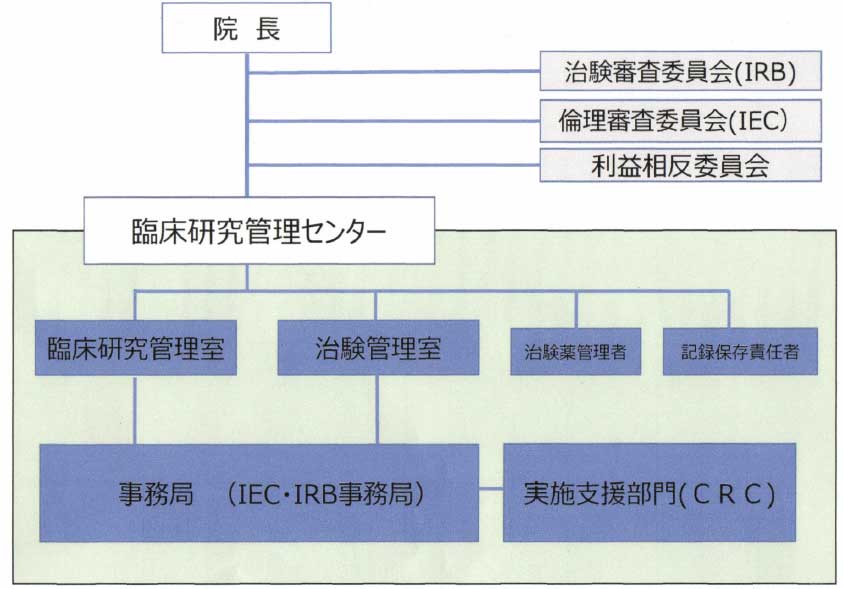
臨床研究管理センター
臨床研究管理センター
当院は、治験を実施するにあたりGCPを遵守して、倫理性・科学性・信頼性を確保するため、平成15年4月に「治験支援室」を発足、その後臨床研究の推進および平成26年の「人を対象とする医学系研究に関する倫理指針」の改正に伴い、平成28年4月に「臨床研究管理室」に名称を変更しました。
さらに「個人情報保護法」の改正、平成29年の「人を対象とする医学系研究に関する倫理指針」の改正と「臨床研究法」の公布に伴い、平成30年4月からはこれまで実施してきました治験および治験を除く臨床研究(臨床試験)を管理する組織として「臨床研究管理室」を改め、「臨床研究管理センター」が新たにスタートしました。
臨床研究管理センターは「治験管理室」と「臨床研究管理室」で構成されています。
さらに「個人情報保護法」の改正、平成29年の「人を対象とする医学系研究に関する倫理指針」の改正と「臨床研究法」の公布に伴い、平成30年4月からはこれまで実施してきました治験および治験を除く臨床研究(臨床試験)を管理する組織として「臨床研究管理室」を改め、「臨床研究管理センター」が新たにスタートしました。
臨床研究管理センターは「治験管理室」と「臨床研究管理室」で構成されています。
現在に至るまで
| 平成15年4月 | 治験支援室として発足。 |
|---|---|
| 平成16年4月 | 治験管理室に名称変更。 |
| 平成28年4月 | 臨床研究管理室に名称変更。 |
| 平成30年4月 | 臨床研究管理センターに名称変更。 |
事業方針
治験における倫理性・科学性・信頼性を確保します。 治験はGCP(医薬品の臨床試験の実施の基準に関する省令)を遵守して行います。
静岡県治験ネットワーク(ファルマバレーセンター)
とおとうみ臨床試験ネットワーク
へ積極的に参加します。
静岡県治験ネットワーク(ファルマバレーセンター)
とおとうみ臨床試験ネットワーク
へ積極的に参加します。
治験審査委員会(IRB)
標準業務手順書に沿って、治験依頼者が立案した治験計画を審査し、その目的、方法などが科学的又は倫理的に適正であるか、さらに被験者の立場にたって、その治験の実施が妥当かどうかを判断しています。原則として月1回開催しています。
治験の実施
- 治験の依頼受付(治験依頼者、ファルマバレーセンター等)
↓ - ヒアリング(医師・看護部・薬剤科・臨床検査技術科・治験依頼者等)
↓ - 治験審査委員会(IRB)で審査
↓ - 承認
↓ - 治験契約
↓ - スタートアップミーティング
↓ - 被験者のリクルート・同意書の取得
↓ - 治験薬投与
被験者への対応・モニタリング・直接閲覧・有害事象報告等
↓ - 治験終了
症例報告書・直接閲覧・監査・必須文書保存