当下,有哪种药物能说自己比ADC更火?答案一定是核药。
今年以来,全球核药代表性厂商Lantheus和Telix股价均大幅上涨近50%,昭示着核药领域存在强大的爆发潜力。
据2022年5月发表的《国内外放射性药品市场分析》,美国FDA共批准52种放射性药物上市,自2016年来FDA批准了9款放射性核素偶联药物(RDC)。

(图源:中信证券)
核药的市场威力在欧美市场被率先验证,诺华两款核药产品:治疗胃肠胰腺神经内分泌瘤的Lutathera在2018年获批以来累计销售额超过20亿美元;治疗前列腺癌的Pluvicto在2022年3月上市以来累计销售额超过4.82亿美元,一度出现供不应求。
全球市场的火热也在激发着国内市场的热情,2022年核药是我国创新药领域过亿级融资事件占比最高的细分赛道,累计融资近9亿。
8月10日,国内核药领域布局先锋远大医药(0512.HK)发布了2023年中期业绩报告:上半年公司实现收入约59.9亿港元,同比增长约14.9%;期内归母净利润约11.2亿港元,同比增长约3.1%。
远大医药核药抗肿瘤板块上半年取得了十分亮眼的表现,公司多款创新RDC药物国内一期临床获得批准(包括TLX250-CDx、TLX101、ITM-11),其核药布局呈现多点开花的局面。
代表未来的核药,到底能给国内药企赋予多大的禀赋?一切需要从其疗效和市场潜力说起。
01
核药市场空间和潜在成为类ADC爆款的共性
据中信医药研究院数据显示,2022年全球核药市场规模约60亿美元。
尽管当前核药整体市场规模并不算大,但全球核药市场正处于爆发的前夕。在全球已获批的核药中,诊断性核药占主导地位,未来随着治疗性核药的临床应用范围持续扩大,全球核药市场将迈入高速增长的阶段。2026年,全球核医药市场有望超过120亿美元,其中预计治疗性放药复合年均增长率39.1%;诊断性放药复合年均增长率为7%。
目前核药领域标志性大事件是2014年拜耳Xofigo和2021年诺华Lutathera的获批,有机构预测未来5年内治疗性核药将迎来第三次增长浪潮。
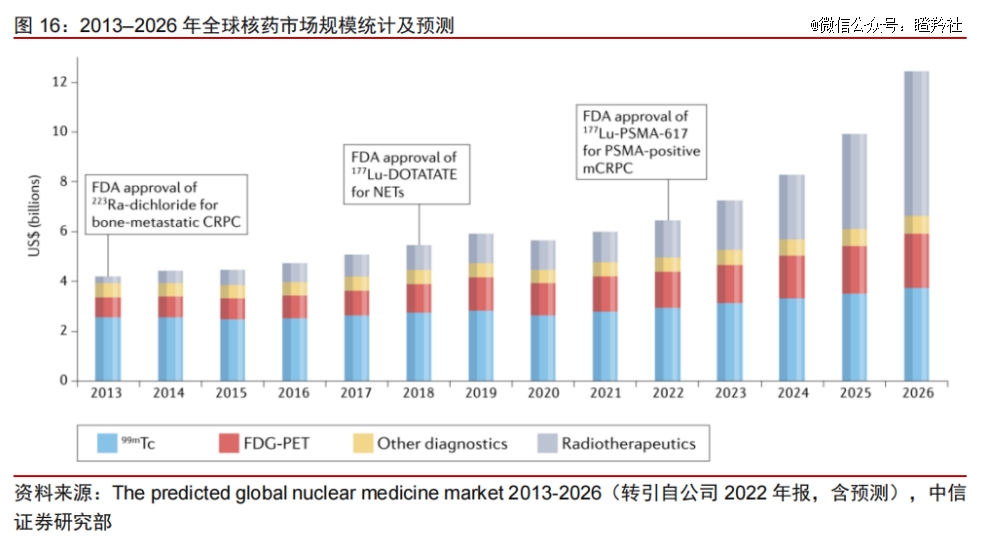
(图源:中信证券)
与全球相比,中国核药市场更是方兴未艾,存在极大的发展潜力。
据德邦医药数据显示:2020年国内核药市场规模约为13亿美元,2017-2020年复合增速为9.9%,预计2022-2026 年间以10.7%的增速稳定增长,2026年市场有望接近24亿美元。

(图源:德邦医药)
全球投资者将关注重心大部分放在抗体偶联药物领域(ADC),殊不知,核药领域同样具备像ADC一样诞生诸多爆款的潜力。
ADC由于结合了抗体的靶向定位功能、小分子毒素对肿瘤的强大杀伤力,被业界称为精准放大版的“化疗”。
不过,尽管ADC成为众多巨头玩家眼中的“宠儿”,但也存在不少的缺点,一方面由于ADC的毒素发挥作用需要通过内吞和旁观者效应两种方式,导致其对Linker和连接方式提出了很高的要求,所以安全性一直是ADC研发的难题,目前高效的ADC普遍毒性较高;另一方面,大多数ADC也会出现耐药的问题,大大影响了用药周期。
核药中的放射性核素偶联药物(RDC),是目前靶向治疗*潜力的发展方向之一,主要由靶向定位元件(抗体或小分子)、连接臂、螯合物和放射性同位素四个部分构成。在与ADC的结构差异上,RDC不再是小分子,而是放射性核素。
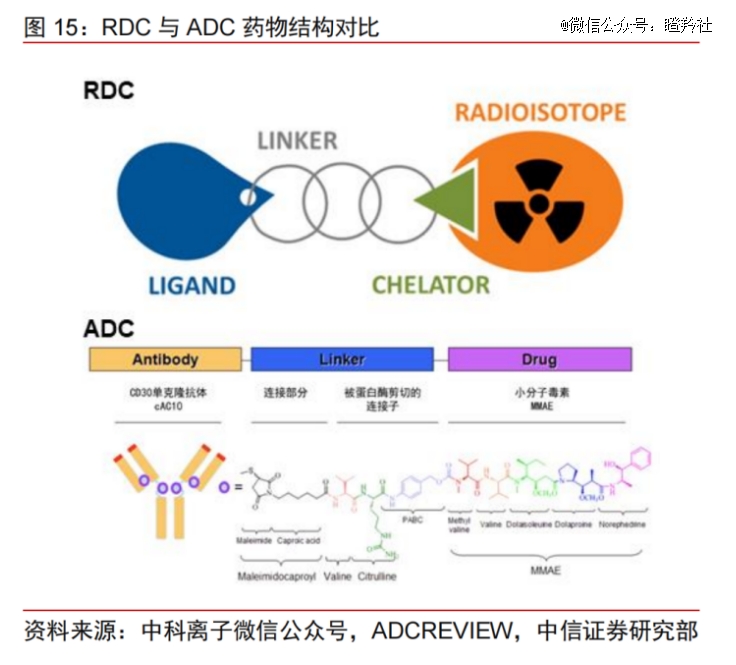
(图源:中信证券)
核素不需要和细胞接触才能起效,通过放射性射线即能破坏细胞染色体,所以对于RDC来说只需要设计稳定的连接子,这也使得RDC较少发生脱靶效应,稳定性和安全性较好。RDC依靠直接的核素内照射,可降低肿瘤细胞放射抵抗的耐药机会。
同时,使用不同的医用核素,可以起到不同的显像或治疗作用,部分核素兼备两种能力,可形成肿瘤精准诊疗一体化。
众所周知,ADC以有效性优良著称,如果在不良反应率方面进行有效的控制,那么意味着其非常有望打开一二线治疗,赢得更大的市场空间,而RDC有效性和安全性“双优”的特性,更是未来多款肿瘤治疗爆款药物的“温床”,并不逊色于ADC。
02
国内格局豹变,远大医药领跑一众国内玩家
放眼全球,目前专注&从事核药的企业数量相对较少,业内领军企业均为诺华、拜耳、GE、Lantheus等巨头,主要受限于核药高壁垒的进入门槛和上游的原材料供给。
视角回到国内,我国核药发展起步较晚,国产核药研制进展较慢,市场基本由跨国药企垄断,自主研发的国产创新核药缺乏,临床使用的放射性药物大部分为国外仿制药物。直到2020年5月,我国建立了*个核药临床前安全评价实验室(GLP),大部分国内核药研发企业技术能力薄弱、产业规模较小。
目前国内企业的现状不仅源于起跑较晚,与核药的研发难度和政策壁垒不无关系:
1)由于核药属于放射性物质,所以核药产业链各环节受国家部门的严密监管,目前具备生产资质的核药企业仅有20余家,行业竞争恶化概率较小;
2)医用同位素的制备主要源于核反应堆辐照,我国虽有5个反应堆,但堆产医用同位素超90%依赖进口,上游原材料受限;
3)核药半衰期较短,使得核药的分发配送环节需要一个强大的核药房供应网络,不仅要考虑生产资质还要保证及时配送;
4)核药创新研发技术平台的形成需要时间和资金的强大积累投入,如诺华花费了超过60亿美元建设核药技术平台;而RDC需要除了筛选高效表达的抗体基因序列,还要考虑放射性核素的剂量和结构配比、核素标记等问题,形成一个稳定的技术平台;
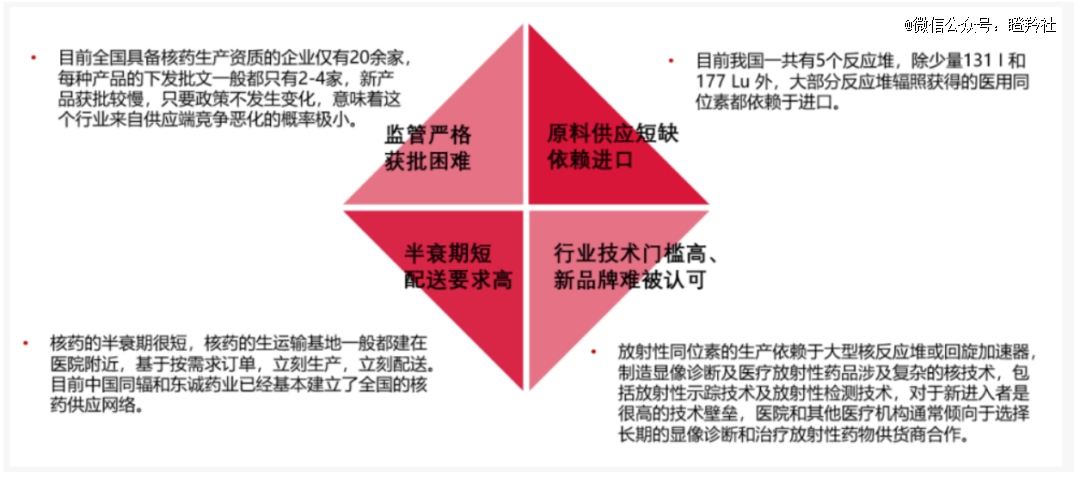
(图源:浙商创新)
近年来,包括2021年《医用同位素中长期发展规划(2021-2035年)》等政策激发了市场对于核药领域的热情,引得新老药企加快对该领域的布局,新兴的如先通医药、辐联医药、药明博锐为在一级市场获得巨额融资,而老牌药企恒瑞医药也加快了核药管线研发进度。
仍需正视的是,短期内诸如恒瑞医药、先通医药和原子高科等研发的镥[177Lu]氧奥曲肽注射液等自研产品以“Fastfollow”或“仿制”为主,尚未形成研发&产品核心竞争力;相反,部分老牌企业通过“收购+合作+自研”组合拳,不仅实现了创新产品商业化,还获得相对成熟的核药技术平台。
远大医药是其中的佼佼者,也是国内最早布局核药以及最强的核药龙头之一。通过2018年起对Sirtex、Telix以及ITM的合作布局,目前远大医药核药板块已拥有超过400名员工,其中硕博占比近40%,公司搭建了*创新能力的肿瘤介入技术平台和RDC技术平台。
通过远大医药在国内多年经营和一系列的对外合作布局,公司已实现了研发、生产、销售、监管资质等多个环节完整的产业链布局,拥有放射性药品生产许可证、放射性药品经营许可证以及辐射安全许可证等一系列核药相关许可资质。

(核药领域并购案例图源:肽研社)
同时,远大医药也是拥有核药管线最多的国内企业之一,也是国内拥有RDC管线最多的玩家。远大医药核药管线目前已储备13款创新产品,涵盖68Ga、177Lu、131I、90Y、89Zr、99mTc在内的6种放射性核素,覆盖了肝癌、前列腺癌、脑癌等在内的8个癌种,产品种类涵盖诊断和治疗两类药物。

(图源:远大医药投资者关系公众号)
03
新核药龙头的禀赋:管线梯队扎实,商业化产品陆续兑现
远大医药已经形成了以易甘泰®钇[90Y]为核心的一套完整的核药管线体系集群,梳理各管线的特点,不难看出公司在核药的布局十分有章法,而且有自己一套独特的打法策略。
远大医药的核药板块分为介入治疗和RDC药物,在介入治疗方向,公司重磅创新产品易甘泰®作为全球*一款用于结直肠癌肝转移选择性内放射治疗(SIRT)的产品,目前已经在国内17个省市的超40家医院开展正式手术。
以易甘泰®目前的已完成的手术情况分析,其未来渗透率和销售收入有望进一步快速爆发。数据显示,中国每年新发结直肠癌症患者超过30万,有20%-30%的结直肠癌患者确诊时就已经发生肝转移;而从总体来看,50%-70%的肠癌患者会有肝转移的情况,比例相当之高。另外,肝癌的空间同样可观。中国年新发肝癌病例超过40万,其中仅有20%可选择手术治疗,超过80%患者发现就已经到晚期,治疗方案十分有限。
易甘泰®钇[90Y]迭代了现有*的治疗方式,同时也正在美国顺利推进治疗原发性肝癌的临床研究(国内真实世界研究预计将于今年下半年开展)拓宽适应症;与现有一线疗法索拉非尼相比,易甘泰®治疗晚期肝癌疗效相当,但严重不良反应减少,大大提升了患者的PFS和OS。根据远大医药公告,在已接受易甘泰®手术的患者中,目前有10余名患者顺利实现肝癌肿瘤降期转化并实施了肝癌切除手术,实现临床治愈。在所有可随访到3个月及以上的患者中,30余位患者症状完全缓解,无需切除,随访到的患者疾病控制率超过70%,治疗效果十分显著。
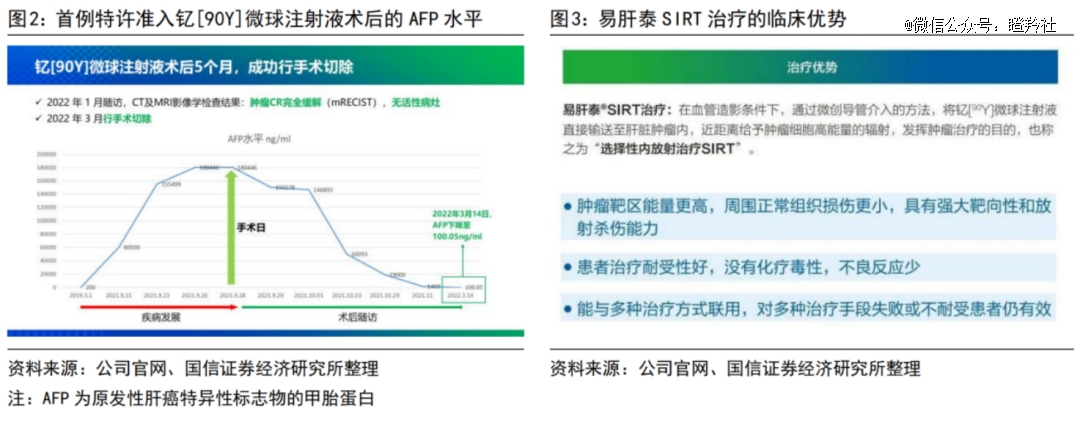
(图源:国信证券)
不难看出,远大医药核药抗肿瘤诊疗板块中介入治疗方向的易甘泰®钇[90Y]是定位于全球成熟产品引进国内进行“降维打击”和惠及更多拥有未满足需求的患者,而公司在核药赛道的另一重点战略布局则是RDC药物。
从远大医药国内进入IND阶段的RDC管线布局分析,公司除了对前列腺癌、胃肠胰神经内分泌瘤、肾细胞癌、脑胶质瘤等适应症进行差异化布局,公司治疗性RDC产品海外临床进度大部分均处于注册性临床,成药性均获得初步验证,为产品国内临床的顺利开展奠定了坚实的基础。
与诺华Pluvicto一样,远大医药的TLX591同样具备爆品潜质。前列腺特异性膜抗原(PSMA)在大多数前列腺癌病灶中高表达,已经在前列腺癌的分子诊断和靶向治疗领域充分被验证。而TLX591与诺华Pluvicto不同的地方在于:Pluvicto的弹头是多肽,而TLX591的弹头则是对PSMA有高度亲和力的人源化单抗J591。
目前,全球处于临床三期的治疗前列腺癌药物超过十款,但靶向PSMA的核药就只有诺华Pluvicto和远大医药的TLX591,TLX591的I/II期临床显示:接受TLX591治疗后79.6%的患者PSMA显像阳性,高剂量TLX591组的中位生存期为27.8个月,初步验证了有效性和安全性。
(图源:智慧芽)
另外,TLX591伴随诊断产品TLX591-CDx的进展也十分亮眼,该产品在国内的三期临床试验近日已完成首例患者给药;海外方面,TLX591-CDx已在美国、澳大利亚等地获批,在英国和欧盟的上市申请也在推进中。该产品上市后的销售表现十分亮眼,其今年上半年在美国录得约合10.1亿人民币的销售收入,环比增长近64%;TLX591-CDx自2022年在美国正式上市后,已累计录得约17.1亿人民币的销售收入。
远大医药布局的另一个产品组合TLX250,其伴随诊断产品TLX250-CDx的进度同样*于治疗产品TLX250。2022年11月,TLX250-CDx三期临床结果显示:对于通过目前临床常用诊断方法CT或MRI提示存在肾脏肿块但无法判断是否为透明细胞肾细胞癌(ccRCC)的患者,TLX250-CDx正电子发射断层成像(PET)在诊断ccRCC的敏感性和特异性上分别达到86%和87%,远超美国FDA要求的预设阈值。这项临床结果表明了TLX250-CDx将有望为临床提供一种准确性高且无创的ccRCC诊断方案,并有望成为ccRCC全新的临床诊断标准。TLX250-CDx早前已获美国FDA授予突破性疗法,其在国内一期临床试验也已顺利完成首例患者给药。
另一方面,TLX250-CDx用于三阴性乳腺癌(TNBC)以及非肌层浸润性膀胱癌(NMIBC)等多项适应症的拓展临床研究也在同步推进中,其拓展适应症海外二期临床研究已完成首例患者给药。

除上述三款核心临床管线外,远大医药还布局了用于治疗胃肠胰腺神经内分泌瘤(GEP-NETs)的RDC药物ITM-11(与诺华Lutathera同靶点同适应症),ITM-11采用的无载体177Lu,与并与公司的伴随诊断产品TOCscan®形成组合,实现对GEP-NETs的诊疗一体化;与目前常用的有载体177Lu核素产品相比,无载体的177Lu拥有更高的比活度和纯度,而且生产过程中产生的长半衰期杂质少,放射污染小,有望成为GEP-NETs“Best-in-class”产品。另外,远大医药还布局了胶质母细胞瘤治疗产品TLX101(国内IND已获受理)、恶性肿瘤骨转移治疗产品ITM-41,强大而全面的RDC产品体系在国内核药市场的优势更加凸显。
结语:在核药/RDC这项属于未来的爆款领域,远大医药凭借着超前的布局、前期大量的投入,已经占住国内的研发创新的先手棋,未来也有望打破国内核药双寡头的竞争格局。随着RDC产品逐渐兑现,核药板块将成为远大医药业绩快速增长的强大爆破点,并将公司创新药业务带领到国内的*梯队。
【本文由投资界合作伙伴微信公众号:瞪羚社授权发布,本平台仅提供信息存储服务。】如有任何疑问,请联系(editor@zero2ipo.com.cn)投资界处理。